O que são gorduras?
Vamos voltar no tempo e relembrar um pouco as aulas de química do
ensino médio. Gorduras, conhecidas também como lipídios, são substâncias
químicas formadas basicamente por ácidos graxos e glicerol (a proporção
é de três moléculas de ácidos graxos ligadas a um glicerol). Elas podem
ser encontradas na natureza sob a forma sólida (gordura) ou líquida
(óleos). Mas por que elas acabaram ocupando um papel tão importante na
nossa alimentação? Basicamente porque são essenciais para o nosso
organismo. Em primeiro lugar, é uma importante fonte de energia,
altamente concentrada. São nove calorias por grama, mais que o dobro da
quantidade de energia existente nos carboidratos e proteínas (4 cal/g),
as outras substâncias básicas que compõem a nossa alimentação. Também
fornecem vitaminas (A, D, E e K), revestem e protegem órgãos vitais. A
digestão das gorduras é mais lenta, o que garante uma sensação de
saciedade e um intervalo maior entre as refeições. Os ácidos graxos são formados por cadeias de carbono (18 ou mais átomos).Óleos e gorduras são tipos de lipídios compostos majoritariamente por compostos denominados triacilgliceróis. Estes se enquadram na classe dos glicerídios e provêm da reação entre ácidos graxos (ácidos carboxílicos de cadeia longa) e o glicerol (propano-1,2,3-triol).
A reação acontece entre uma hidroxila do glicerol e o grupo COOH (carboxila) do ácido. Note que a presença de três grupos hidroxila na molécula de glicerol torna possível que a reação aconteça com consumo de até três moléculas de ácido graxo para cada uma de glicerol. Neste caso, irá se formar a função éster no produto final, o triacilglicerol. Chamamos compostos deste tipo de ésteres de ácidos graxos. Como são três cadeias de ácidos graxos ligadas ao glicerol, nomeia-se a molécula triacilglicerol. Veja a ilustração a seguir.
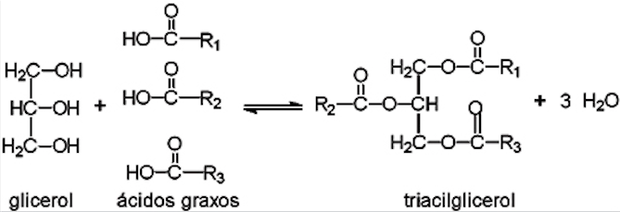 Reação de formação de um triacilglicerol (Foto: Wikipedia)
Reação de formação de um triacilglicerol (Foto: Wikipedia)Óleos (ou gorduras) são neutros, de natureza apolar (não polar), e são concomitantemente hidrofóbicos (fobia de água), por não interagirem com a água, e lipofílicos (afinidade por lipídios), por serem solúveis em outros tipos de lipídios (óleos, solventes orgânicos).
Apesar das propriedades semelhantes, óleos e gorduras se diferenciam
pelo estado físico. Os óleos se apresentam no estado líquido em condições
ambiente, e as gorduras são encontradas no estado sólido nas mesmas condições.
Além da diferença no estado físico, o conjunto de grupos provenientes de ácidos
graxos (R1,R2e R3 ) varia de um para o outro.
Em geral, gorduras apresentam grupos de ácidos graxos (R1,R2e R3 ) de cadeia saturada (apenas ligações simples entre átomos de
carbono da cadeia), e óleos apresentam estes mesmos grupos com algumas ligações
duplas, o que influencia no estado físico da substância.
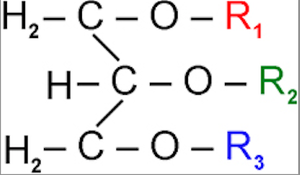 Estrutura genérica de um trialcilglicerol (Foto: Wikipedia)
Estrutura genérica de um trialcilglicerol (Foto: Wikipedia)Sabões e detergentes
Gorduras e lipídios, como mencionado no texto, não interagem com água. Desta forma, quando estes constituem sujeiras ou é desejável removê-los de algum recipiente, torna-se necessária a presença de algum composto que tenha caráter “híbrido”, polar e apolar ao mesmo tempo (caráter anfifílico), para que este possa interagir com ambos, água e óleo (ou gordura), e seja capaz de promover a retirada do composto que não se deseja. Estas substâncias são os sabões ou os detergentes. Vejamos suas estruturas para entender melhor como agem na limpeza de objetos.
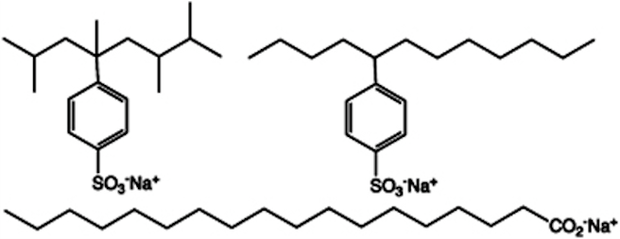 Molécula de detergente e sabão (Foto: Wikipedia)
Molécula de detergente e sabão (Foto: Wikipedia)Ação dos detergentes e sabõesA ação dos agentes de limpeza é simples. Inicialmente, ocorre a formação da micela porque, ao dissolver o detergente (ou sabão) em água, existirá uma tendência entre as partes apolares de se unirem, formando uma estrutura similar à indicada na figura ao lado. Esta estrutura “capturará” a substância indesejável (gordura/óleo) em seu interior. O lipídio passa, então, para o interior de uma estrutura que é solúvel em água e esta o retira do recipiente com mais facilidade.
Saponificação
A formação dos sabões (haletos orgânicos) é realizada via reação de um triacilglicerol (gordura ou óleo) com solução de hidróxido de sódio (NaOH) ou com outro hidróxido como o KOH, e aquecimento.
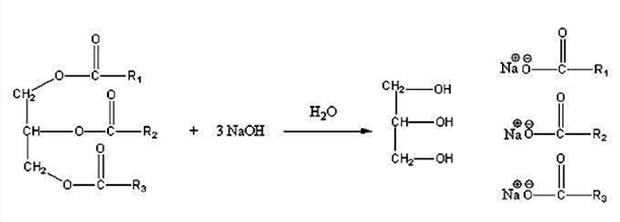 Reação de Saponificação de um triacilglicerol (Foto: Wikipedia)
Reação de Saponificação de um triacilglicerol (Foto: Wikipedia)
FONTES: MICHA, R. Óleos,
gorduras, sabões e detergentes. Disponível em: http://educacao.globo.com/quimica/assunto/quimica-organica/oleos-gorduras-saboes-e-detergentes.html.
Acesso em maio de 2016.
NAVARRETE, G. Óleos e gorduras.
Disponível em: http://super.abril.com.br/ciencia/oleos-e-gorduras.
Acesso em maio de 2016.
Nenhum comentário:
Postar um comentário